Introducción Lactasa
La principal fuente de energía de la leche es el disacárido denominado lactosa. La enzima responsable de la hidrolización del disacárido de lactosa es la beta galactosidasa. La lactasa es un miembro de la familia de enzimas de la b-galactosidasa.
Una proporción de la población produce menos lactasa durante la adultez. Esta proporción varía del 5 % en el norte de Europa a un valor tan elevado como el 90 % en algunos países africanos y asiáticos. La resultante intolerancia a la lactosa puede provocar vómitos, dolor de estómago y diarrea.
El estudio del tamaño y la estabilidad de la lactasa resulta interesante, dado que en la bibliografía se ha informado sobre una gran variedad de tamaños y pesos moleculares1,2.
Dispersión dinámica de la luz
La dispersión dinámica de la luz (DLS) es un método físico mediante el cual se mide el tamaño de las suspensiones de partículas pequeñas o macromoléculas en una solución. Dado que el analito en la solución se mueve aleatoriamente a causa del movimiento browniano, la interferencia en la luz dispersa debido al número de partículas crea fluctuaciones de intensidad. En una medición de DLS, se registra la fluctuación dependiente del tiempo en la luz dispersa mediante un fotodiodo de avalancha de recuento de fotón único. Se utiliza un autocorrelacionador digital para extraer la función de correlación, a partir de la cual se calculan el tamaño y su distribución.
La DLS requiere de la selección de un ángulo de medición. Las mediciones bajas del ángulo frontal son propensas a recibir interferencias de polvo y son más difíciles de utilizar. Dicho tipo de mediciones se reserva para experimentos en donde es necesario contar con una sensibilidad máxima para una detección agregada. El ángulo de medición clásico es de 90 grados, ya que cuenta con una serie de ventajas pero minimiza el volumen de dispersión. Esto significa que se observan menos partículas, por lo que se limita la sensibilidad del instrumento. Un ángulo de retrodispersión aumenta el volumen de detección de la muestra, acorta el tiempo de medición y mejora la sensibilidad al tiempo que minimiza los efectos del polvo.
Ensayo
Para los fines de la caracterización, se escogió la lactasa producida comercialmente del Aspergillus oryzae. Las muestras se disolvieron en solución salina tamponada de fosfato (PBS, en inglés) durante 30 minutos previo a su uso, y luego se las filtró con un filtro de 5 µm.
Se utilizó el sistema cromatográfico Agilent serie 1200. El eluyente contenía 0,1M de sulfato y 0,1M de fosfato con azida sódica al 0,05 % para evitar el crecimiento bacteriano. El solvente se desgasificó al vacío y se filtró con un filtro Anotop de 0,1 µm en un frasco de vidrio, y la tasa de flujo se estableció en 0,5 ml/minuto. El loop de inyección fue de 50 µl. La separación se realizó a 25 °C en una sola columna Tosoh G3000SW XL, diseñada para el uso en cromatografía de exclusión por tamaño (SEC).
Se empleó el mismo Zetasizer Nano-S de Malvern Instruments para la medición de lotes DLS, y para la medición SEC de la enzima. Dado que no se necesita calibrar los instrumentos, se estima que el método es absoluto. La caracterización mediante SEC combinada con DLS se conoce con la sigla SEC-DLS.
En modo de flujo, se colocó el Zetasizer después del detector UV existente, mientras que para las mediciones de lotes, se retiraron las celdas de flujo y se utilizaron cubetas plásticas desechables.
Resultados y consideraciones
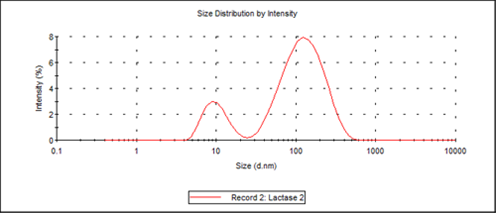
Para la medición de lotes de muestras recientemente preparados, se observaron dos poblaciones de tamaños, el primero a 10,3 nm y el segundo a alrededor de 140 nm. La limitación de la separación de tamaño de dos poblaciones para el lote DLS es de una diferencia de 3:1 en los tamaños promedio, por lo que no se puede resolver cualquier sistema de monómero-dímero mediante DLS sin separación previa, ya que estos difieren solo por un factor de alrededor de 1,3 en su tamaño hidrodinámico. En la figura 1 se ilustra la distribución por intensidad de los 2 picos.
Figura 1: Distribución de la intensidad del tamaño de partícula obtenida para la lactasa, y filtrada mediante un filtro de 5 µm de tamaño de poro.
Al usar la utilidad proteica del software Zetasizer de Malvern Instruments, el peso proteico estimado para una proteína con un diámetro molecular de 10,3 nm, es de 156 kDa (156 000 g/mol). Este peso molecular coincide con los valores descriptos en la bibliografía2, 3.
También se analizó la lactasa mediante SEC-DLS, cuyos resultados se describen en la figura 2.
Figura 2: Cromatografía de exclusión por tamaño de lactasa. Se observa un pico de agregación a los 5-6 ml mientras el monómero se encuentra a 8,5 ml. Se ilustran todos los estados de agregación intermedios.
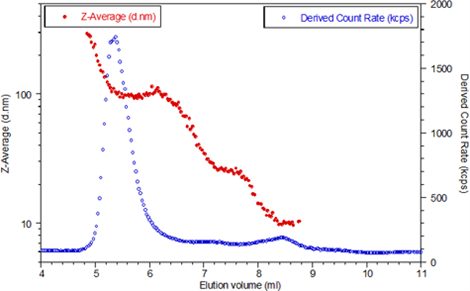
La lactasa se eluyó entre los 4 ml y los 11 ml, por lo que solo se presenta esta parte de la cromatografía. Los círculos azules representan la intensidad de dispersión o la tasa de recuento derivada, medida por el instrumento. La tasa de recuento derivada es la intensidad de dispersión total que considera cualquier atenuante, por lo que representa la verdadera tasa de recuento en un rango de dispersión dinámica muy amplio. Los círculos rojos son el tamaño hidrodinámico medido para cada corte de elución. El sistema se ajustó para medir el tamaño cada 3 segundos.
La cromatografía muestra que la lactasa agregada se eluye, en primer lugar, a alrededor de 5-6 ml. Se registraron diámetros hidrodinámicos de hasta 300 nm para los agregados más grandes, con una meseta de alrededor de 100 nm de diámetro, consistente con el pico del tamaño más grande medido en “modo lote”.
En la cromatografía también se muestra el agregado de lactosa con un tamaño que oscila de 100 a 25 nm. Como se ilustra en la curva azul, estos agregados se dispersan con mucha menos intensidad. El gráfico de intensidad de dispersión muestra un salto cercano a los 8,5 ml, que es la lactasa monomérica. El diámetro hidrodinámico medido para el monómero es constante con un valor promedio de 10,15 nm.
Tendencias de temperatura
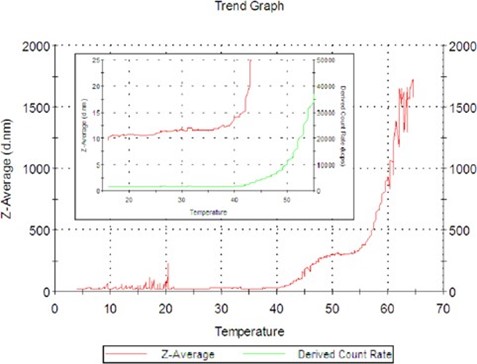
También se analizó la estabilidad de la temperatura y la desnaturalización de la proteína. En la figura 3 se muestra el promedio Z (diámetro hidrodinámico en nanómetros) versus la temperatura para la enzima recientemente filtrada con un filtro Anotop de 0.02 µm[MC1].
Figura 3: Gráfico de tendencias de temperatura de la lactasa.
El tamaño del promedio Z de la enzima aumenta desde 40 ºC, luego se desnaturaliza rápidamente por encima de los 55 ºC.
Este es un comportamiento interesante ya que muestra una conformación estable o semiestable en forma de meseta en la tendencia, con un tamaño de 300 nm a alrededor de 50 °C.
En la figura 3, el gráfico insertado muestra la tasa de recuento en verde y el tamaño del promedio Z. Esta es una repetición del ensayo anterior pero finalizado a 55 °C. En mayor detalle se muestra que el tamaño de la enzima aumenta de 10 a 12 nm entre los 20 °C y los 40 °C, lo que indica que existe algún tipo de cambio en la conformación de la lactasa en el búfer PBS. Hay un marcado aumento del tamaño por encima de los 40 °C, tal como se mencionó anteriormente.
Estabilidad dependiente del tiempo
Se midió el tamaño de la solución de lactasa en PBS durante un tiempo para verificar la estabilidad. Se midió una muestra filtrada con Anotop de 0,02 micrones durante un período de 18 horas. El tamaño de la muestra creció durante este tiempo alrededor de 10 nm a partir de un solo pico, generando dos poblaciones; una aún de 10 nm y la otra de alrededor de 250 nm, lo que indica, una vez más, la existencia de un estado estable más elevado de agregado de lactasa en PBS.
Referencias
[1] J. Potter M.-W. Ho, H. Bolton, A. J. Furth, D. M. Swallow & B. Griffiths, Biochem. Genet. (1985) 23, 423-439
[2] H. K. F. Lau, Biochem. J. (1987) 241 567-
[3] G. M. Gray, N. A. Santiago, E. H. Colver y M. Genel, J. Clin. Invest. (1969) 48(4) 729-735