La administración exacta de medicamentos a sitios de acción específicos es un área muy extensa y de actividad permanente dentro de la tecnología.
Los beneficios de la administración de medicamentos sofisticados son muchos; entre los objetivos mas atractivos podemos mencionar la menor cantidad de efectos colaterales, dosis más bajas y la capacidad de tratar condiciones que de otra manera serían intratables. Lo mismo sucede con la generación de una nueva propiedad intelectual cuya patente original se venció.
El término “sistemas de administración de medicamentos” encierra una amplia variedad de técnicas, entre las que se incluyen los aerosoles para inhalación, las cápsulas de alta tecnología que liberan la droga en partes específicas del cuerpo, dispositivos transdérmicos y reservorios oftálmicos. En este artículo veremos un resumen de una ruta diferente, la de los sistemas inyectados, y en particular aquellos en los cuales la droga se encuentra en un dispositivo coloidal o de micropartícula. La idea de inyectar los medicamentos en una especie de “paquete” no es nueva; en 1960 Paul Erlich acuñó el término “bala mágica” para referirse a un dispositivo que llevaba las drogas directamente a un sitio específico (Erlich, 1906).
Sin embargo, pasó mucho tiempo antes de que se encontrara la primera tecnología coloidal potencialmente útil. Fue a través del descubrimiento de los liposomas (Bangham, 1958), que eran estructuras vesiculares huecas compuestas de fosfolípidos. Los farmacéuticos aprovecharon los liposomas para desarrollar una enorme cantidad de literatura sobre formulaciones liposomales de todas las drogas virtualmente imaginables. La mayor parte de este material es de valor dudoso o está basado en una terapéutica improbable. No es sorprendente que muy pocas de estas formulaciones se hayan convertido en productos viables o que incluso ahora, más de 30 años después, los primeros productos liposomales estén empezando a entrar al mercado. En retrospectiva, tampoco sorprende que muchos de estos proyectos hayan fracasado. En muchos casos, las formulaciones eran bastante ingenuas y su caracterización era insuficiente; además, los desarrolladores subestimaron masivamente el nivel de sofisticación técnica requerido para comprender la operación del sistema in vivo e in vitro.
Es posible comenzar a entender estos sistemas únicamente con la aplicación de técnicas modernas en caracterización coloidal. Los liposomas son un ejemplo excelente de esto.
Administración de medicamentos liposomales
Los liposomas se forman al dispersar un fosfolípido en agua. Su tamaño puede variar desde unas pocas decenas de nanómetros a varios micrones, dependiendo de la forma en que fueron generados. Su superficie química está relacionada con los fosfolípidos utilizados para producirlos. Una gran cantidad de los primeros estudios realizados describían a los liposomas como neutrales, ácidos o básicos. El liposoma de tipo neutral estaba hecho en base a fosfatidilcolina; al de tipo ácido se le agregaban lípidos ácidos (por lo general fosfatidilserina) y al tipo básico se le agregaba estearilamina.
Por lo general, se partía del supuesto de que sus cargas eran cero, negativa y positiva respectivamente en un pH 7. Solamente con la aparición posterior de instrumentos capaces de medir el potencial Zeta (por ejemplo la serie Zetasizer) se pudo evaluar la verdadera naturaleza de estos sistemas sobre la base de una rutina.
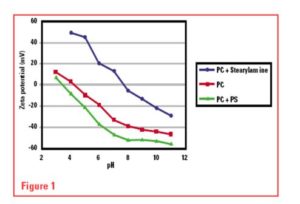
La Imagen 1 muestra el potencial Zeta de tres sistemas liposomales como una función del pH, ahora sabemos que los liposomas “neutrales” tenían una carga altamente negativa en muchos casos, porque solamente se necesitan de 1-2% de los lípidos ácidos para suministrar una carga de ~ -40 mV.
No resulta sorprendente que muchas de las primeras conclusiones con respecto a la relación entre carga de superficie y comportamiento in Vitro presentaran conflictos o resultaran inválidas.
La caracterización del tamaño de los liposomas también tuvo mucha importancia. Los liposomas formados a partir de técnicas de “agitación” a baja velocidad (o cizallamiento ligero) eran grandes y polidispersos; los que se formaban a alta velocidad (o cizallamiento alto) (por ejemplo con ultrasonido) podían llegar a ser muy pequeños, con un diámetro que podía alcanzar los 20 nm.
En consecuencia, el análisis sofisticado del tamaño de la partícula es de vital importancia; los sistemas más grandes pueden caracterizarse con difracción de luz o detección de zona eléctrica, pero los sistemas más pequeños necesitan técnicas de dispersión de luz dinámica. Una vez más, muchos de los primeros en investigar el tema trabajaron con la técnica incorrecta o informaron que el tamaño se medía por “tamaño láser” y esto daba lugar a muchas interpretaciones. Por supuesto, el tamaño es de gran importancia para determinar el comportamiento in vivo, los liposomas más grandes estaban instalados en el lecho capilar del pulmón (con la urgencia repentina de patentar tratamientos para el cáncer de pulmón) y los más pequeños absorbidos por el hígado y el bazo.
En este sentido es esencial una caracterización detallada de las formulaciones. La capacidad de la luz dinámica dispersa para medir las distribuciones de tamaño es particularmente útil, debido a que permite la investigación del efecto de pequeños cambios en la formulación. Por ejemplo, puede ser esencial para evitar la formulación de partículas grandes o agregados en la formulación, que transportan la mayor parte de la masa. La capacidad del algoritmo CONTIN para desentrelazar las distribuciones de manera confiable demostró tener una utilidad sobresaliente en este sentido.
Las defensas del cuerpo
La capacidad del hígado y el bazo para absorber los coloides inyectados continúa siendo un problema central para esta ruta de administración de medicamento. Las células inmunes llamadas macrófagos tragan las células, como lo harían con cualquier objeto extraño en circulación, para luego degradarla o metabolizarla. De este modo, el transportador del medicamento no permanece en circulación por el lapso necesario e incluso puede dirigir el medicamento a las rutas metabólicas que estamos tratando de evitar. Prevenir la absorción de este sistema denominado retículoendotelial es un desafío mayor, y se está realizando un pequeño progreso al estudiar los efectos de la química en la superficie de los coloides sobre el comportamiento de las partículas in vivo. En la actualidad, el enfoque más exitoso fue rodear la partícula con una capa de polímero injertado o absorbido con grupos de cadena larga de polioxietileno, que se extienden en el ambiente acuoso.
El espesor de tales capas de polímeros varia de 1-10 nm para la mayoría de los polímeros (en este sentido, se realizaron estudios exhaustivos en las poloxaminas poloxámeras) y se utilizó la dispersión de luz dinámica para medir el espesor en la capa de polímero interfacial (Muller 1991). La desventaja de este enfoque es que el espesor de la capa se mide por diferencia, y por lo tanto las mediciones deben ser exactas. Actualmente la dispersión de neutrones promete brindar información más detallada (Washington et al 1995), particularmente en sistemas de emulsión, donde la partícula “desnuda” no puede medirse con fines de substracción. Por ende, ahora tenemos liposomas con fosfolípidos PEG que se denominan “liposomas furtivos” con tiempos de circulación vascular extendidos (por ejemplo. Mayhew et al, 1992).
Sistemas coloidales modernos para la administración de medicamentos
Se realizaron estudios sobre una amplia gama de sistemas coloidales alternativos para la administración de medicamentos. El poliestireno fue estudiado extensivamente desde que está disponible en los tamaños de monodispersores exactos, permitiendo el estudio del efecto de tamaño sobre el comportamiento in vivo. Sin embargo, el poliestireno no puede ser metabolizado, y se acumula en el cuerpo. Por este motivo, la mayoría de los estudios ahora se concentran en sistemas “biodegradables” que pueden ser metabolizados mientras hacen su trabajo. Algunos de los más populares en este momento son:
- Partículas basadas en Acido Poli láctico (PLA), poliglicolato (PLG), y copolímeros de este estilo (PLGA) (McGee et al 1995, Hausberger and Deluca 1995). El método de evaporación de disolvente es la técnica más popular para formular estos materiales. En resumen, el polímero y la droga son disueltas en un disolvente (por lo general diclorometano) y esta solución se dispersa en agua con un surfactante (que suele ser alcohol polivinílico) a través de la utilización de una técnica de cizallamiento alto como el ultrasonido o la microfluidización. El disolvente luego se evapora, y deja las partículas de polímero cuyo tamaño va de 80 a 500nm. Más recientemente el polímero se modificó al injertar las cadenas de óxido de polietileno para que formen materiales PLA PEG, que formen tanto sistemas de micelas como autoensamblaje de partículas. La capacidad de medir el tamaño utilizando la dispersión de luz dinámica es esencial para estudiar estos sistemas, en los cuales las partículas del autoensamblaje pueden tener tamaños tan pequeños como 10nm.
- Las emulsiones, en especial las que se basan en triglicéridos vegetales estabilizados por fosfolípidos. Estos materiales fueron utilizados durante varias décadas para la administración intravenosa de grasas con fines nutricionales (“Intralípidos” y sistemas similares).Estos sistemas también son extremadamente útiles, ya que los medicamentos hidrófobos se disuelven en aceite antes de la emulsificación. El tamaño de la gota es normalmente de alrededor de 250 a 350 nm, y los sistemas son estabilizados electroestáticamente por el emulsificador. Durante la última década se alcanzó una comprensión detallada de estos sistemas a través del uso de la dispersión de luz dinámica para estudiar el potencial zeta y su relación con la química de superficie. Este laboratorio llevó a cabo estudios que investigaron la relación entre el potencial Zeta, la absorción iónica, y la estabilidad, donde mostró cómo formular emulsiones estables con medicamentos. En el mercado ya hay emulsiones de diazepam (Diazemuls, Kabi Pharmacia;Von Dardel 1983) y Propofol (Diprivan, Zeneca; Glen and Hunter 1984) y una amplia gama de otros medicamentos están en etapa de investigación. El problema más significativo con los sistemas de emulsión es que pueden atravesar la coalescencia con un aumento en el tamaño de la gota si no están bien formulados. Esto puede representar una dificultad cuando se recurre a la dispersión de luz dinámica para medir los tamaños de la gota, debido a que las gotas más grandes pueden salir del rango de tamaño cubierto por DLS; por este motivo la difracción es más apropiada. Por lo tanto, el uso de ambas técnicas es esencial para tales formulaciones, y en realidad, este enfoque es de gran valor en el estudio de la estabilidad de todos los sistemas de administración coloidal.
- Micropartículas protéicas, como los compuestos de albúmina. (Truter 1995, Shafi et al 1995).Para lograr estas partículas, se disuelve la albúmina y el medicamento en agua, y esta solución se dispersa en aceite (por lo general aceite de oliva) en un homogeneizador. Se agrega un agente de entrecruzamiento como el glutaraldehído para desnaturalizar la proteína, aunque también se puede recurrir al calentamiento. Las partículas sólidas de albúmina con la droga pueden recuperarse a partir del aceite. Esta técnica crea partículas con un diámetro de 1-10μm, un tamaño superior al normalmente considerado para la administración intravenosa. En consecuencia, estas partículas son utilizadas para el estudio de la embolización arterial, particularmente en el tratamiento de tumores hepáticos o pulmonares. Las partículas tienen el tamaño suficiente como para alojarse en el lecho capilar cerca del tumor, donde inhiben el flujo sanguíneo y dejan sin oxígeno al tejido tumoral. Más recientemente, se realizaron partículas de albúmina lo suficientemente pequeñas como para circular libremente a través de la técnica de coacervación, en la cual la solubilidad de la albúmina desciende con la sal.
Conclusiones
Estas ideas representan tan solo una pequeña fracción de la actividad actual en administración de medicamentos a través del sistema coloidal. El desarrollo de esta tecnología está expandiendo nuestros límites de comprensión de la ciencia coloidal y los sistemas con organización propia. También utiliza métodos físicos tan diversos como la dispersión neutrónica o de luz, microscopía de sonda de barrido y modelado molecular. Esperamos que la administración de medicamento con el sistema coloidal brinde respuestas a algunos de los problemas terapéuticos más desafiantes durante el nuevo milenio.