Introducción
Se define como medicamento “genérico a uno idéntico o bioequivalente” a otro de marca reconocida.
El término genérico también se refiere a un medicamento que se comercializa con su nombre químico, sin nombre comercial. Por ejemplo, se vence la patente de un medicamento pero el laboratorio desea continuar con la venta en una versión genérica. Los medicamentos genéricos aprobados por la Administración de Alimentos y Medicamentos (FDA según sus siglas en Ingles) deben cumplir con los mismos estándares que el medicamento original, a saber:
- Contener el mismo ingrediente activo que el medicamento original
- Ser potencialmente idéntico.
- Tener las mismas indicaciones de uso.
- Ser bioequivalente.
- Cumplir con los mismos requerimientos de lote en cuanto a identidad, potencia, pureza y calidad.
- Cumplir con los mismos estándares impartidos por la FDA en cuanto a las regulaciones correspondientes a las buenas prácticas de manufactura.
En 1984 el Acta de Competencia de Precios de Drogas y de Restauración de los Términos de las Patentes reguló el procedimiento para el reconocimiento de drogas genéricas. El solicitante debe completar una Solicitud Abreviada para Nueva Droga (ANDA según sus siglas en Inglés) y la droga debe estar previamente aprobada e incluida en el listado de referencia (2). Una vez que la solicitud es aprobada, la FDA agrega la droga a la lista de Productos de Drogas Aprobados también conocida como el “Libro Naranja” que muestra la relación entre el medicamento genérico y la lista de medicamentos de referencia (original).
Para mostrar que un medicamento genérico es bioequivalente a un medicamento original, la biodisponibilidad debe ser comparable a la obtenida cuando es estudiado bajo condiciones experimentales similares (3).
La biodisponibilidad es la velocidad y la extensión con la cual el ingrediente activo es absorbido de un medicamento y se torna disponible en el sitio de acción de la droga; y bioequivalencia se refiere a la emisión equivalente de la misma sustancia de droga a partir de dos o más medicamentos o formulaciones (4).
La premisa que subyace en esta ley de 1984 es que los productos bioequivalentes son terapéuticamente equivalentes y, por lo tanto, intercambiables.
Malvern Instruments recibió muestras de tabletas originales y genéricas de un producto con ingrediente farmacéutico activo dual (API según sus siglas en Inglés). El objetivo era investigar la distribución del tamaño de la partícula (PSD según sus siglas en Inglés) de cada uno de los APIs en el momento de desintegración de la tableta, ya que se espera un efecto significativo sobre la biodisponibilidad subsiguiente de la droga.
El presente artículo describe de qué manera la combinación del análisis de imagen automatizada con Espectroscopía Raman en Morphologi G3-ID puede aplicarse para identificar químicamente y aislar las partículas de interés dentro de una formulación. De este modo, se pueden obtener componentes específicos (PSD) .
Método
Las tabletas suministradas contenían la misma dosis en los dos APIs. Ambos eran prácticamente insolubles en agua. Por lo tanto, fueron utilizados como medio para la disolución/desintegración; el supuesto era que la mayor parte de partículas API no se disolverían. Se disolvió una tableta de cada tipo (genérica e original) en 100 ml de agua. Se realizó una submuestra con 2 mililitros que fueron diluidos con 20 ml adicionales de agua. Se colocaron 2 mililitros de esta suspensión en una pipeta y luego en un portaobjetos de microscopio revestido en aluminio. Se la dejó secar toda la noche. El tamaño y la forma de la partícula fueron analizados con imagen automatizada; se utilizaron ajustes determinados que se guardaron como procedimiento de funcionamiento estándar.
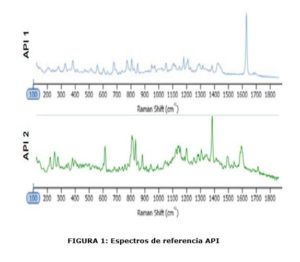
Se creó una biblioteca de referencia espectral para la muestra al tomar espectros de punto de los componentes “puros”, Figura 1. Para este análisis, el rango de tamaño de interés fue entre 1 y 10 μm y se obtuvieron los espectros Raman de las partículas solamente dentro de este rango de tamaño. Los espectros de partícula fueron preprocesados para minimizar la variación de la línea de base, que luego fue correlacionada con la biblioteca de referencia espectral. Cuanto más similar es un espectro de partícula al componente de la biblioteca, más cercano es el puntaje de correlación a 1. La clasificación final de las partículas se basó en su identidad química y la distribución de tamaños.
Resultados
No fue posible diferenciar los dos APIs a través de un análisis de parámetros morfológicos con los resultados de imágenes de partículas solamente. La forma de las partículas era muy similar. Con la información espectroscópica Raman para la identificación química se diferencia fácilmente entre los dos APIs como se observa en la Figura 2. Este diagrama de dispersión traza los puntajes de correlación para los componentes de los dos API. Los API 1 y API 2 están claramente separados por los datos Raman. En la figura también se ven imágenes de ejemplo de partículas. Una vez que pueden diferenciarse las dos poblaciones API es posible determinar los PSDs individuales a partir de las mezclas.
La Figura 3 muestra la superposición de la “Distribución del diámetro circular equivalente” (CED según sus siglas en Inglés) por número para cada API a partir de las poblaciones químicamente definidas. Parece haber una cantidad menor de partículas de API 1 en la tableta genérica que en la tableta original. Aparentemente, las PSDs de API 2 funcionaron bien para las dos tabletas.
La Figura 4 y la Figura 5 muestran los cuadros de clasificación donde se comparan las dos clases de API para los dos tipos de tableta en conteo de porcentaje y volumen de porcentaje respectivamente. Las tabletas contienen cantidades iguales de cada API en sus formulaciones, pero aparentemente la tableta original contenía una proporción mayor de API 2 que de API 1 que la tableta genérica en las muestras analizadas.
Si se comparan estos resultados in vitro con los datos in vivo, se podría obtener más información para determinar si esta diferencia observada logra la biodisponibilidad real del producto de droga genérica y por lo tanto su bioequivalencia con el producto original.
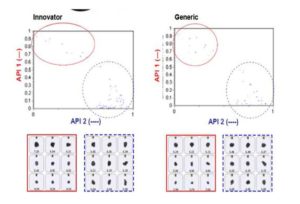
Figura 3: Revestimiento de API PSDs para ambas tabletas
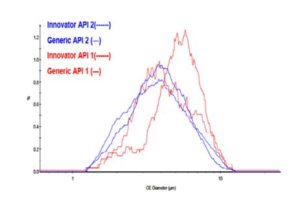
Figura 3: Diagrama de Dispersión de los valores de puntaje API e imágenes de ejemplo de cada clase
Conclusiones
Si se combinan la imagen de partícula automatizada y la espectroscopía Raman en un instrumento se logra la Microscopia Raman Dirigida Morfológicamente. De este modo se pueden comparar y caracterizar de manera independiente los componentes individuales presentes en una combinación o mezcla. Con una herramienta de estas características se puede comprender mejor el producto en muchas áreas de la industria farmacéutica, desde los aspectos regulatorios hasta la detección y resolución de problemas. Sin embargo, no se limita al área farmacéutica únicamente y también es aplicable a otras muestras con efecto Raman.
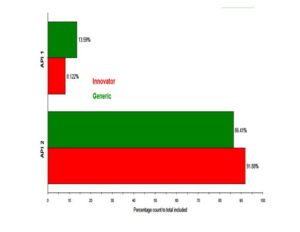
Figura 4 Cuadro de clasificación con las clases de API por recuento de porcentaje.
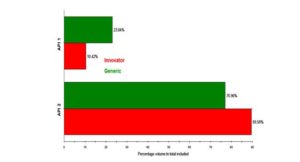
Figura5: Cuadro de clasificación con las clases de API por volumen de porcentaje.