La cromatografía de exclusión por tamaño (SEC) o la cromatografía de permeación por gel (GPC) son procedimientos frecuentemente utilizados en los laboratorios de biociencia para caracterizar proteínas purificadas y recombinantes. Esta técnica también fue utilizada para medir el peso molecular o para resolver mezclas de monómeros, oligómeros y agregados de orden más elevado. Con la utilización de este método, el peso molecular se calcula creando una curva de calibración de proteínas globulares estándar y luego se compara el tiempo de elución de una muestra con los estándares. El método es limitado porque se basa en una relación estable entre peso molecular, tamaño, forma o volumen hidrodinámico. Esta relación varía significativamente entre proteínas al introducir inexactitudes no cuantificables en todas las mediciones realizadas en esta modalidad.
Los sistemas analíticos modernos pueden hacer mucho más que la detección de muestra con un detector de concentración simple. Con los detectores múltiples, que incluyen el de índice de refracción (RI), ultravioleta (UV), dispersión de luz (LS) y viscosimetría (IV) es posible realizar la caracterización extensiva de las muestras de proteínas de una forma más absoluta que en el pasado. Con los detectores de RI y de UV se pueden obtener las mediciones de concentración exactas. Su uso combinado permite realizar análisis de conjugación. Para medir el peso molecular sin tener que recurrir a la calibración de columna puede utilizar los detectores de luz dispersa. La viscosidad intrínseca es una medida de la densidad molecular y posibilita la evaluación de cambios estructurales. Para calcular el tamaño (RH) se combinan la dispersión de luz y la viscosidad intrínseca. A este procedimiento se lo denomina tetra detección. En la figura 1, se observa un esquema de un tetra detector típico del sistema analítico SEC. Este artículo describe algunas aplicaciones comunes del sistema analítico SEC avanzado en la caracterización de proteínas, que supera la capacidad de un sistema de detector simple.
Peso molecular
Las proteínas individuales tienen un peso molecular muy bien definido. Una vez sintetizadas dentro de una celda, y tras cualquier procesamiento posterior, como la escisión de proteínas y la glicosilación, se podrá determinar el peso molecular de la proteína con una variación mínima. La medición del peso molecular de una proteína nueva es interesante en sí misma.
Las proteínas pueden tener pesos moleculares significativamente diferentes, por lo tanto medir el peso molecular de una proteína purificada es una forma excelente de confirmar que la muestra purificada contiene la proteína que buscamos. La confirmación de que el peso molecular es el esperado es un buen indicador de que la línea celular huésped está realizando la producción de una proteína recombinante de manera correcta.
Figura 1. Esquema de un sistema SEC analítico tetra detector.
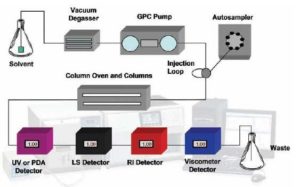
- Reservorio de Solvente
- Degaseador por vacío
- Bomba GPC
- Muestreador automático
- Lazo de Inyección
- Horno de columna y Columnas
- Detector de PDA o UV Detector
- LS Detector
- RI Detector
- Viscosímetro Residuos
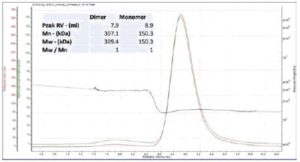
Figura 2. Medición de lgG por SEC que muestra los pesos moleculares del dímero y monómero.
Por lo tanto, la medición del peso molecular es importante desde el punto de vista académico y desde el punto de vista práctico como indicador de la calidad de la muestra o el producto. La Figura 2 muestra un ejemplo de un anticuerpo (lgG), una proteína comúnmente utilizada en drogas biofarmacéuticas. Su peso molecular es 150kDa y es una constante a lo largo del pico. También se observa un pico secundario muy pequeño cuyo peso molecular resultó ser apenas superior a 300kDa. El peso molecular sugiere que este pequeño segundo pico es un dímero estable presente en la muestra. Con esta información, el dímero puede considerarse aceptable para la calidad del producto o ser sometido a purificación de ser necesario.
Estado de oligomerización
La actividad de las proteínas se define por la estructura final o conformación que logra. La estructura cuaternaria define el complejo final que se forma cuando las cadenas de proteína múltiple se juntan y forman una unidad simple. El SEC analítico también puede evaluar ese proceso.
Las proteínas son monodispersas a nivel individual, y esto significa que sus pesos moleculares son estables a lo largo del pico ya que eluyen a partir de una columna de SEC. A medida que las proteínas múltiples se juntan y forman oligómeros, el peso molecular presenta un aumento discreto que resulta en cambios del peso molecular en el marco del cromatograma.
En el caso de los homo oligómeros, cuando una cierta cantidad de proteínas idénticas se juntan, el peso molecular será un múltiplo del peso molecular del monómero, y de esa forma el número del olígomero puede obtenerse con un cálculo simple. En la Figura 3 se observa que el peso molecular del BSA aumenta de un pico a otro. Cada uno de los pesos moleculares corresponde a un múltiplo del peso molecular del monómero; en este caso es hasta dos y tres veces, y esto indica la presencia de dímeros y trímeros.
En el caso del trímero, su peso molecular un poco más alto del esperado y el crecimiento a volúmenes de retención más rápidos dentro del pico, sugieren que este pico también contiene oligómeros más grandes. El peso molecular continúa en ascenso e identifica la presencia de algunos agregados mayores. Los oligómeros, que tienen algo de actividad, se distinguen claramente de los agregados mayores (que estarán inactivos) por los pesos moleculares estables a lo largo del pico. Por supuesto, con el detector RI o UV se puede medir la proporción de cada uno de manera individual para poder determinar la composición general de la mezcla de oligómero.
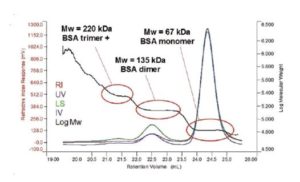
Figura 3. En esta muestra BSA se observa la medición del peso molecular de cada pico. Los pesos moleculares corresponden al monómero y dímero. El peso molecular del tercer pico está ligeramente por encima del trímero, y este hecho indica que lo incluye al igual que a otros oligómeros de orden más elevado.
Cuantificación de agregado
El agregado de proteínas es un resultado común de muchos tratamientos de muestra, almacenamiento prolongado o congelamiento. La estructura de la proteína permanece unida como resultado de las fuerzas de Van der Waals, los lazos de hidrógeno y las interacciones hidrofóbicas. Al cambiar las condiciones, el delicado equilibrio que une la estructura puede resultar interrumpido y pueden surgir regiones enterradas en la cadena de polipéptidos. Estas regiones pueden interactuar con aquellas que se encuentran en otras proteínas y formar complejos más grandes de proteínas mal plegadas. Las regiones hidrofóbicas son particularmente susceptibles a este efecto. Estas fuerzas unen a los agregados, y esto significa que su formación es irreversible y que continuarán creciendo. Las proteínas pierden la actividad y pueden llegar a un punto en el que dejan de ser solubles. Los agregados de proteínas tienden a tener un peso molecular muy alto y suelen ser muy polidispersos, debido a que los complejos formados no tienen muchas posibilidades de convertirse en estructuras estables con tamaños predecibles.
En SEC, los picos de agregados pueden aparecer en el volumen en vacío de la columna porque son demasiado grandes como para penetrar a los poros del material de embalaje. Su peso molecular puede tener un significado limitado considerando su elevada polidispersión aunque, sin embargo, es susceptible de medición junto con su concentración si se utiliza el índice refractivo o UV.
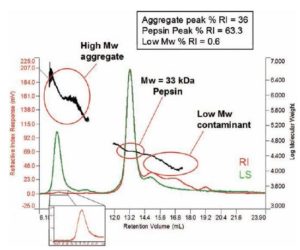
Figura 4. El detector de dispersión de luz identifica con claridad el agregado de peso molecular elevado mientras que el detector de concentración, en este caso RI, puede ser utilizado para calcular la proporción de la muestra que compone este material.
La sensibilidad relativa de la dispersión de luz y los detectores de concentración implican que en el caso de cantidades muy pequeñas de material con peso molecular muy elevado, la concentración puede estar por debajo del límite del detector de concentración, en cuyo caso la dispersión de luz actúa efectivamente como una “primera respuesta” a la formación de agregados. Si su concentración es lo suficientemente elevada significa que puede medirse. En la Figura 4 se observa una muestra de pepsina con una pequeña cantidad de material agregado. Su peso molecular alto y su elevada polidispersión son típicos de las proteínas agregadas. El pico de RI pequeño permite determinar la concentración como una proporción del material total y, como se observa forma el 0.6% de la muestra. En esta muestra particular, también se pudo identificar un poco de material de peso molecular más bajo, que compone el 36% de la muestra.
Tamaño e información estructural
La viscosidad intrínseca es inversamente proporcional a la densidad molecular (o volumen específico parcial). Se la puede medir con un viscosímetro. Con la combinación de este último y los datos del peso molecular obtenidos con la luz dispersa también se puede obtener el tamaño molecular. Estos dos valores son muy útiles para evaluar los cambios estructurales entre las muestras. Un cambio en el tamaño y la viscosidad intrínseca con un peso molecular constante es un indicador claro de un cambio en la estructura y, a partir de un aumento o una disminución en la densidad, se puede tener una idea del cambio estructural.
En el caso de las proteínas, la estructura determina la función y los cambios o la pérdida de estructura resultan en modificaciones o pérdida de la actividad. Las proteínas cambian su conformación al ser sometidas a diferentes condiciones, y para evaluarlo se utiliza esta técnica.
La Figura 5 muestra la toxina adenilato ciclasa que cambia su tamaño y viscosidad intrínseca (IV or ή) de forma significativa con un peso molecular constante en presencia o ausencia de calcio. Ante la falta de iones de calcio, la proteína resulta mal desplegada con un IV elevado y un tamaño más grande. Al agregar calcio, la proteína vuelve a su conformación original con un tamaño más pequeño y un IV bastante más bajo. Es importante mencionar que el cambio en el IV es muy superior al cambio en el tamaño y esto demuestra su sensibilidad mayor a estas modificaciones.
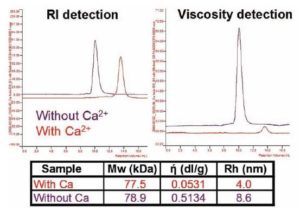
Figura 5. La viscosidad intrínseca de la toxina adenilato ciclasa cambia drásticamente ante la presencia o ausencia de calcio.
Conjugados de proteína
Si dos materiales diferentes eluyen de una columna y se combinan dos detectores de concentración, en este caso RI y UV, la concentración de cada componente puede medirse de manera simultánea, siempre y cuando se conozcan los factores de respuesta de cada detector a cada componente.
En el caso de RI y UV, estos factores de respuesta son dn/dc y dA/dc. Esto resulta particularmente interesante para las proteínas conjugadas, ya que es de gran utilidad saber qué cantidad de un segundo material (por ejemplo lípidos de membrana o PEG) está conjugada con la proteína correspondiente. Los estudios de las proteínas de membrana son cada vez más frecuentes en la investigación de biología molecular. La cristalización es uno de los objetivos principales de esta investigación para caracterizar la estructura de la proteína. Sin embargo, la cristalización de estas proteínas demostró ser difícil. La cristalización de una proteína de membrana puede depender de muchos factores como la pureza y la concentración o tipo de detergente; si se extrae una cantidad excesiva del componente detergente de un complejo de proteína de membrana puede haber una degradación de la proteína y una reducción en la posibilidad de cristalización.
Cuando se caracteriza y optimiza la proporción de la proteína y el detergente en una muestra de proteína de membrana purificada se obtiene un análisis de gran valor con respecto a la posibilidad de cristalización y al contenido de proteína del complejo detergente-proteína (PDC).
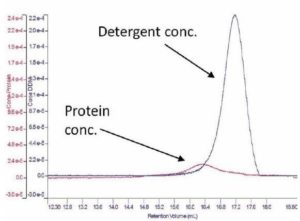
Figura 6. Cromatograma derivado con la concentración calculada de proteína y detergente.
La Figura 6 muestra un cromatograma derivado correspondiente a un estudio de una proteína de membrana purificada con lípidos detergentes que actuaron como membrana sustituta a la cual la proteína debía adherirse. El cromatograma derivado muestra la proteína calculada y las concentraciones de detergente que fueron calculadas con una combinación de los detectores RI y UV.
A partir de los análisis se deduce que es posible calcular la masa del complejo, la proteína y el detergente a través de la identificación de la proteína como monómero conjugado con detergente. Como se observa en la figura, también hay una cantidad excesiva de detergente sin utilizar.
Conclusión
El SEC analítico atravesó un desarrollo significativo desde sus comienzos. Aunque los objetivos originales de la técnica eran las mediciones de peso molecular y purificación, en la actualidad pueden llevarse a cabo las mediciones analíticas de forma más directa. Además, las mediciones concurrentes de la concentración, la viscosidad intrínseca, el tamaño y la conjugación también pueden realizarse con la SEC analítica avanzada, una herramienta de valor incalculable para muchos laboratorios de biociencia. La combinación de estas técnicas convierte a la SEC en una herramienta muy potente para la caracterización de muestras de proteínas.